二、基本知識、理論:
1、空氣的成分:氮氣占78%, 氧氣占21%, 稀有氣體占0.94%,
二氧化碳占0.03%,其它氣體與雜質占0.03%
2、主要的空氣污染物:NO2 、CO、SO2、H2S、NO等物質
3、其它常見氣體的化學式:NH3(氨氣)、CO(一氧化碳)、CO2(二氧化碳)、CH4(甲烷)、
SO2(二氧化硫)、SO3(三氧化硫)、NO(一氧化氮)、
NO2(二氧化氮)、H2S(硫化氫)、HCl(氯化氫)
4、常見的酸根或離子:SO42-(硫酸根)、NO3-(硝酸根)、CO32-(碳酸根)、ClO3-(氯酸)、
MnO4-(高錳酸根)、MnO42-(錳酸根)、PO43-(磷酸根)、Cl-(氯離子)、
HCO3-(碳酸氫根)、HSO4-(硫酸氫根)、HPO42-(磷酸氫根)、
H2PO4-(磷酸二氫根)、OH-(氫氧根)、HS-(硫氫根)、S2-(硫離子)、
NH4+(銨根或銨離子)、K+(鉀離子)、Ca2+(鈣離子)、Na+(鈉離子)、
Mg2+(鎂離子)、Al3+(鋁離子)、Zn2+(鋅離子)、Fe2+(亞鐵離子)、
Fe3+(鐵離子)、Cu2+(銅離子)、Ag+(銀離子)、Ba2+(鋇離子)
各元素或原子團的化合價與上面離子的電荷數相對應:課本P80
一價鉀鈉氫和銀,二價鈣鎂鋇和鋅;
一二銅汞二三鐵,三價鋁來四價硅。(氧-2,氯化物中的氯為 -1,氟-1,溴為-1)
(單質中,元素的化合價為0 ;在化合物里,各元素的化合價的代數和為0)
5、化學式和化合價:
(1)化學式的意義:①宏觀意義:a.表示一種物質;
b.表示該物質的元素組成;
②微觀意義:a.表示該物質的一個分子;
b.表示該物質的分子構成;
③量的意義:a.表示物質的一個分子中各原子個數比;
b.表示組成物質的各元素質量比。
(2)單質化學式的讀寫
①直接用元素符號表示的:a.金屬單質。如:鉀K 銅Cu 銀Ag 等;
b.固態非金屬。如:碳C 硫S 磷P 等
c.稀有氣體。如:氦(氣)He 氖(氣)Ne 氬(氣)Ar等
②多原子構成分子的單質:其分子由幾個同種原子構成的就在元素符號右下角寫幾。
如:每個氧氣分子是由2個氧原子構成,則氧氣的化學式為O2
雙原子分子單質化學式:O2(氧氣)、N2(氮氣) 、H2(氫氣)
F2(氟氣)、Cl2(氯氣)、Br2(液態溴)
多原子分子單質化學式:臭氧O3等
(3)化合物化學式的讀寫:先讀的后寫,后寫的先讀
①兩種元素組成的化合物:讀成“某化某”,如:MgO(氧化鎂)、NaCl(氯化鈉)
②酸根與金屬元素組成的化合物:讀成“某酸某”,如:KMnO4(高錳酸鉀)、K2MnO4(錳酸鉀)
MgSO4(硫酸鎂)、CaCO3(碳酸鈣)
(4)根據化學式判斷元素化合價,根據元素化合價寫出化合物的化學式:
①判斷元素化合價的依據是:化合物中正負化合價代數和為零。
②根據元素化合價寫化學式的步驟:
a.按元素化合價正左負右寫出元素符號并標出化合價;
b.看元素化合價是否有約數,并約成最簡比;
c.交叉對調把已約成最簡比的化合價寫在元素符號的右下角。
6核外電子排布:1-20號元素(要記住元素的名稱及原子結構示意圖)
排布規律:①每層最多排2n2個電子(n表示層數)
②最外層電子數不超過8個(最外層為第一層不超過2個)
③先排滿內層再排外層
注:元素的化學性質取決于最外層電子數
金屬元素 原子的最外層電子數< 4,易失電子,化學性質活潑。
非金屬元素 原子的最外層電子數≥ 4,易得電子,化學性質活潑。
稀有氣體元素 原子的最外層有8個電子(He有2個),結構穩定,性質穩定。
7、書寫化學方程式的原則:①以客觀事實為依據; ②遵循質量守恒定律
書寫化學方程式的步驟:“寫”、“配”、“注”“等”。
8、酸堿度的表示方法——PH值
說明:(1)PH值=7,溶液呈中性;PH值<7 ph="">7,溶液呈堿性。
(2)PH值越接近0,酸性越強;PH值越接近14,堿性越強;PH值越接近7,溶液的酸、堿性就越弱,越接近中性。
9、金屬活動性順序表:
(鉀、鈣、鈉、鎂、鋁、鋅、鐵、錫、鉛、氫、銅、汞、銀、鉑、金)
說明:(1)越左金屬活動性就越強,左邊的金屬可以從右邊金屬的鹽溶液中置換出該金屬出來
(2)排在氫左邊的金屬,可以從酸中置換出氫氣;排在氫右邊的則不能。
更多精彩資訊請關注查字典資訊網,我們將持續為您更新最新資訊!
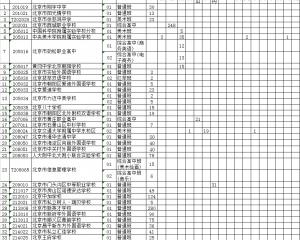 2020年北京市中招參加補錄的學校名單2020-08-19
2020年北京市中招參加補錄的學校名單2020-08-19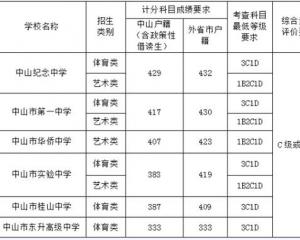 中山2018年中考錄取分數線已公布2018-08-24
中山2018年中考錄取分數線已公布2018-08-24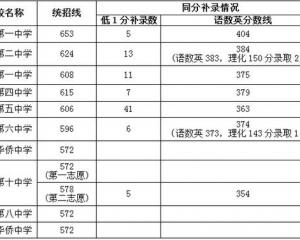 2018年福建莆田中考分數線正式公布2018-08-24
2018年福建莆田中考分數線正式公布2018-08-24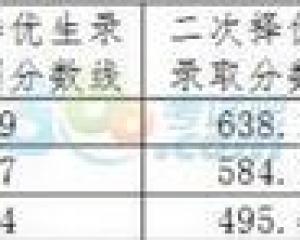 2018年遼寧本溪中考分數線已公布2018-08-23
2018年遼寧本溪中考分數線已公布2018-08-23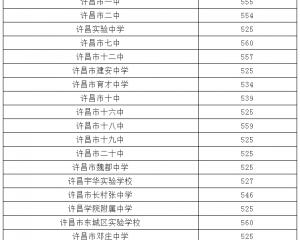 2018年河南許昌中考分數線已公布2018-08-16
2018年河南許昌中考分數線已公布2018-08-16